はじめに
私たちの体は、日々のストレスや老化にさらされながらも、驚くほど安定した機能を保ち続けています。その仕組みを支えているのが、「組織幹細胞」と呼ばれる特別な細胞です。幹細胞は、自らを複製しながら、必要に応じて機能的な分化細胞を供給し、組織の恒常性(ホメオスタシス)を維持しています。病気とは、こうした幹細胞の制御が破綻した状態とも言い換えられます。
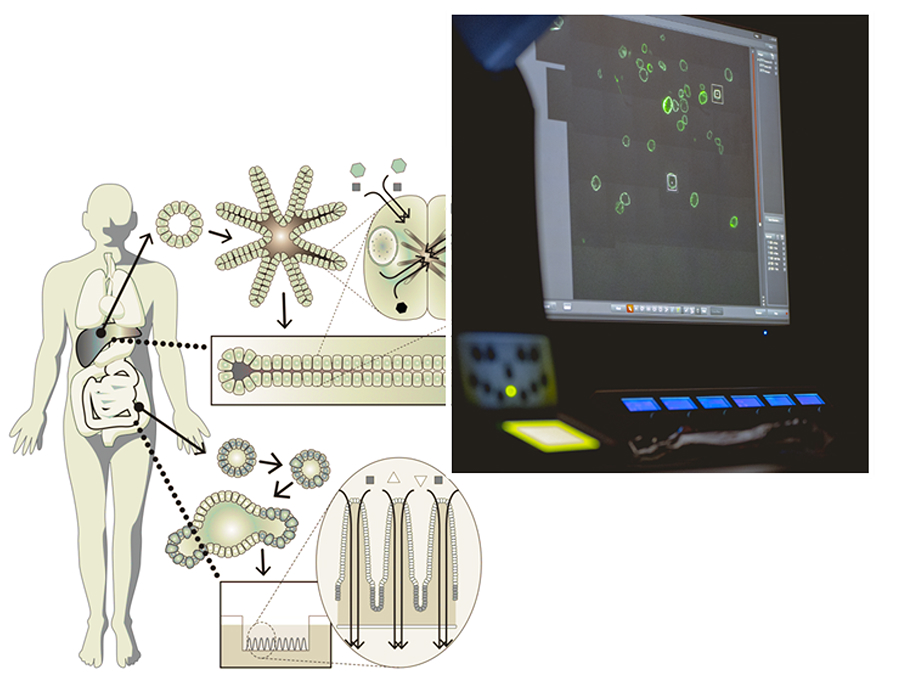
私たちの研究室では、病気の本質を細胞レベルで理解するために、「オルガノイド」と呼ばれる“ミニ臓器”の培養技術を開発・応用してきました。ヒトの組織から幹細胞を取り出し、適切な因子を加えることで、体内に近い構造と機能を持つ三次元の組織モデルを育てることが可能になります。
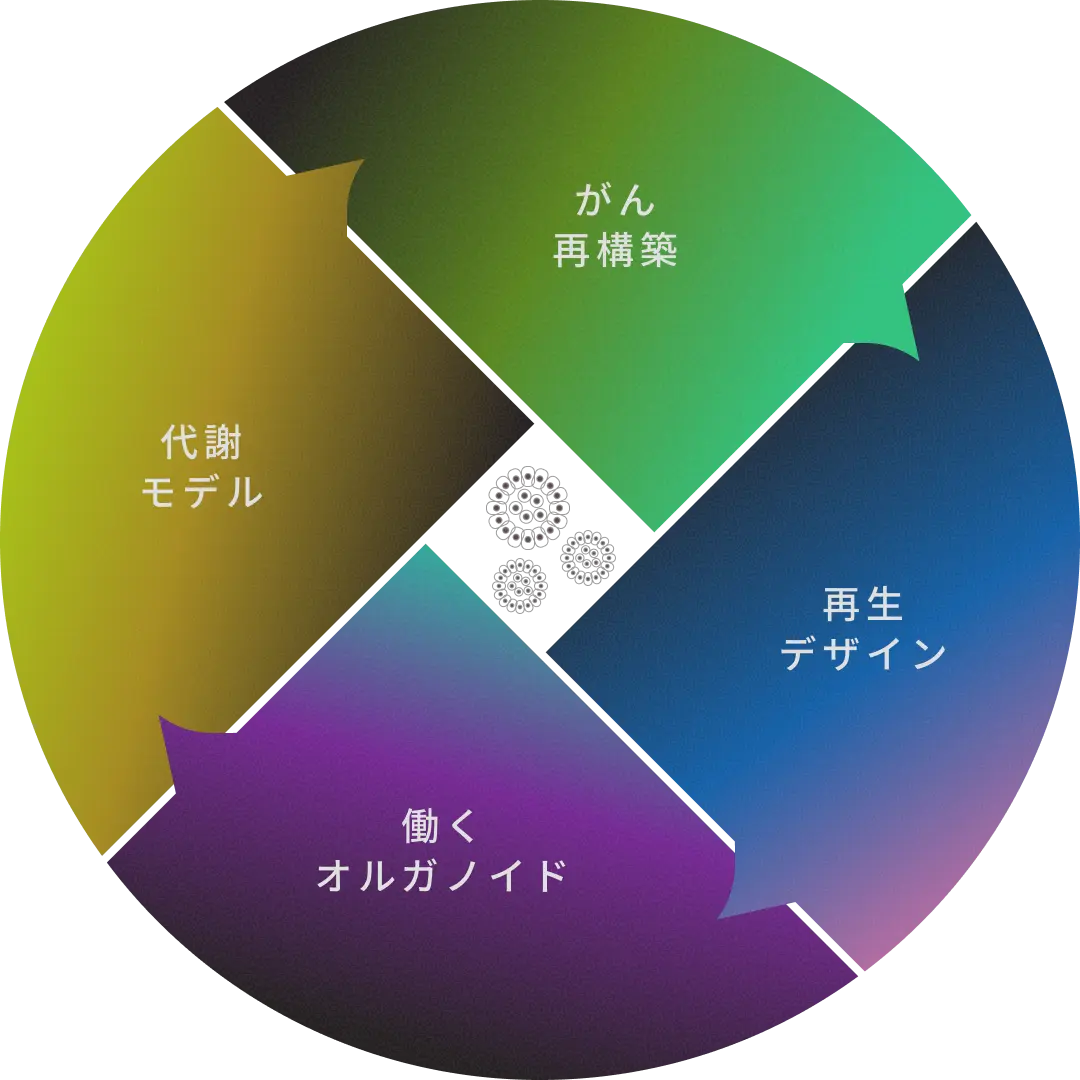
このオルガノイド技術を土台に、私たちは以下の4つの研究テーマに取り組み、病気のメカニズムに迫りながら、新たな医療の道を切り拓こうとしています:
がん再構築 ~がんの「自然史」を再現し、理解を深める~
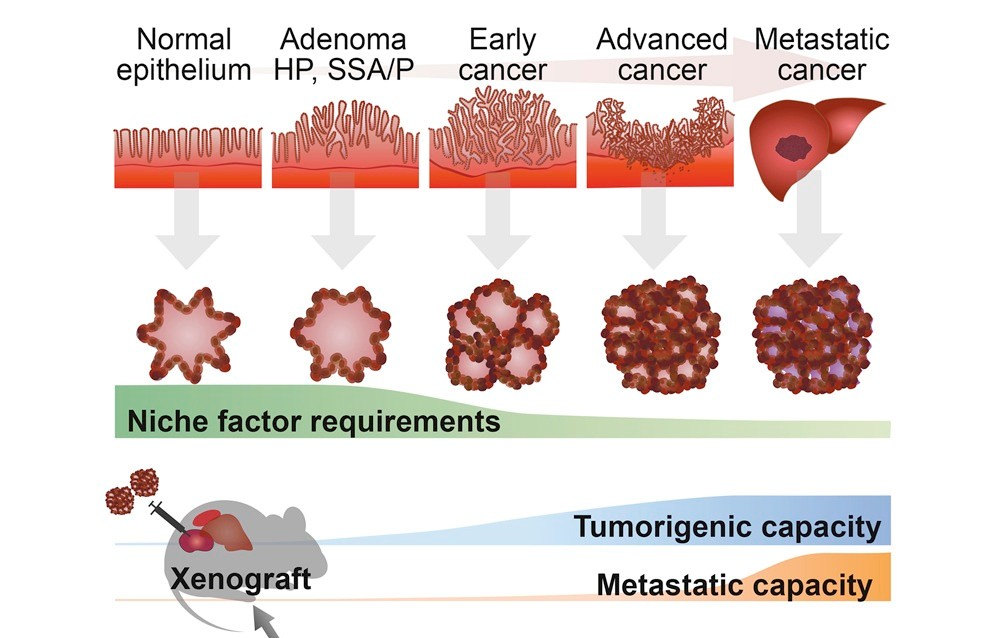
がんは、長年にわたり少しずつ遺伝子やエピゲノムに異常が蓄積され、正常な幹細胞が悪性化していく病気です。私たちは、ヒトのがん組織から三次元的に増殖する「がんオルガノイド」を樹立することで、がんがどのように始まり、進行していくのかを、まるで体内の時間軸をたどるように再構築しています。さらに、がんオルガノイドに遺伝子編集を行ったり、進行する様子を顕微鏡で観察したりすることで、浸潤・転移がどのように起きるのか、どのように薬剤耐性獲得するのかといった、これまで解析が難しかったメカニズムに迫ることが可能になってきています。
主な取り組み
すべての臨床がんを、試験管内でコピーできるか?
ヒトのがん組織から樹立したオルガノイドは、元の組織像や遺伝学的特徴を維持しつつ、腫瘍組織を安定的に三次元培養することが可能です。私たちは、代表的ながん種である大腸がん、胃がん、膵がん、肺がんをはじめ、1,000を超える患者由来のがんオルガノイドを樹立し、がんの多様性(遺伝子・薬剤応答・悪性度)を理解してきました。また、代表的ながんに加えて、神経内分泌癌などの希少がんやモデル化が難しかったがんにも挑戦しています。この一部はオルガノイドコンソーシアムを通じて国内外の企業と共有され、標的探索や創薬に応用されています。
正常細胞からがんを作り出すことはできるか?
がん遺伝子の組み合わせだけで、発がんは再現できるのか?という“究極の問い”に挑むため、正常なオルガノイドに遺伝子変異を導入し、がんの発生プロセスを人工的に再構成するリバースエンジニアリングを進めています。この遺伝子改変を可能にしたのが、私たちが開発したオルガノイドにおけるCRISPR-Cas9遺伝子編集ツールを用いた効率的な遺伝子編集技術です。例えば、ヒト正常大腸上皮オルガノイドを起点に、がんの発生、増殖に直接的な原因として関与する「ドライバー遺伝子」変異を複数導入することで、大腸がんを遺伝学的に再構成することに成功しています。
なぜ、がんは致死的になるのか?
浸潤・転移・薬剤耐性の背景には、ごく少数のがん細胞が新たな腫瘍を作り出す性質が関わっており、これを「がん幹細胞」と呼びます。私たちは、オルガノイド遺伝子編集技術を応用することでこれらのがん幹細胞を可視化・追跡し、その動態や制御の仕組みを明らかにしています。
再生デザイン ~オルガノイドを用いて臓器をつくりかえる~
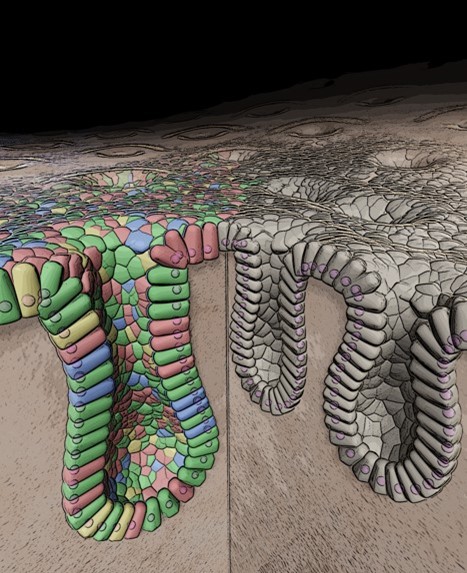
腸はわずか数日で細胞が入れ替わる、非常にダイナミックな臓器です。炎症や外傷で損傷した腸がどのように修復されるのか。その「再生」の仕組みは、従来マウスでしか観察できませんでした。私たちは、ヒト腸オルガノイドを用いて、腸上皮再生のメカニズムを直接捉える研究系を構築してきました。
主な取り組み
大腸を“小腸化”し、失われた小腸機能を補えるか?
組織幹細胞であるオルガノイドは、ヒトの組織からそのまま培養可能であることから、再生医療への応用が期待されています。私たちは、近年若年者を中心に増加傾向である、大腸の粘膜再生障害を伴う潰瘍性大腸炎や、生命維持に必要な消化・吸収を担う小腸の機能的な不足を伴う短腸症候群などの難治性小腸疾患において、オルガノイドを用いた新規治療法開発のためのトランスレーショナルリサーチを推進すべく、研究を続けています。これまで不可能であったヒトの正常腸管上皮オルガノイドを免疫不全マウスの腸管に移植する技術を開発し、移植したヒトのオルガノイドがマウス腸管内でもヒトとしての形質を保った上皮構造を構築し、長期にわたりがん化しないことが確認できました。また、小腸オルガノイドを大腸に移植し、小腸の機能を持つ「小腸化大腸」モデルを開発し、短腸症候群などへの治療応用を目指しています。こうした成果は、オルガノイドを用いた再生医療の可能性を切り拓き、First-in-Human臨床試験への橋渡しとなっています。
働くオルガノイド ~ヒト組織の機能を再現する~
オルガノイド技術により、ヒトの組織を試験管内で培養できるようになり、近年ではiPS細胞からオルガノイドを作ることも可能になってきました。ただし「オルガノイド」とは、あくまで“臓器に似た構造体”を意味し、その多くは形態や遺伝子発現が似ている段階にとどまっています。しかし、私たちの健康や病気を正しく理解するには、組織が本来持つ機能をどこまで正確に“再現・定量”できるかが重要です。これまでのオルガノイド研究では、増殖やタンパク質産生といった比較的単純な機能にとどまっていましたが、実際の組織は「入力→処理→出力(Input–Throughput–Output)」の連続的な機能ネットワークを持ち、それらが複雑かつ堅牢に連動しています。たとえば肝臓では、空腹を感知して糖新生を促進し、血中に糖を放出し、逆に、栄養が十分にあるときには糖新生を止め、余剰の糖を細胞内に取り込む機能を持っています。こうした反応は単純な代謝経路ではなく、多層的な情報制御によって支えられています。私たちは、こうした“働く臓器”の本質に迫るため、以下のような研究を展開しています。
主な取り組み
組織に「似ている」オルガノイドは「働いている」?
培養したオルガノイドが“働く”ためには、細胞極性・オルガネラ構造・タンパク質局在などを含む「機能的成熟」を再現することが大切です。私たちは、従来の分化誘導法(増殖因子の除去)に加え、機能分化を促す未知の因子の探索することで、培養系の高度化を目指しています。また、構造・代謝・情報伝達の3軸から機能を定量化する評価技術を開発することにより、真に機能を持つオルガノイド=Functional Organoidの確立に取り組んでいます。
代謝モデル ~みえない代謝を理解する~
代謝は、生体の維持に欠かせない中心的な機能です。細胞内では、生体に必要な多くの物質が細胞活動に適切なかたちに変換されており、数千もの酵素が関わる化学反応カスケードが緻密に構成された分子ネットワークの下で制御されている必要があります。私たちは、生体内に近い代謝状態の再現を目指し、代謝イメージング、質量分析、フラックス解析などの先端的な手法を組み合わせて、細胞外環境の変化や遺伝的・化学的な刺激に対する細胞応答と代謝変化を詳しく調べています。これにより、細胞の機能成熟を促進する新たな代謝物質の同定と、その作用メカニズムの解明を進めています。
主な取り組み
代謝を試験管内で再現できる?
薬物毒性試験や代謝疾患への創薬において、試験管内で代謝を理解することはとても重要です。しかし、試験管内での永続培養が難しい肝臓などの臓器では、肝細胞を大量生産・維持でき、かつ、その機能を安定的に再現できる技術の開発が望まれてきました。私たちは、代謝の要となる臓器である「肝臓」の働きを反映したモデルの開発に成功しました。現在、このアプローチを他の臓器にも広げる取り組みを進めています。