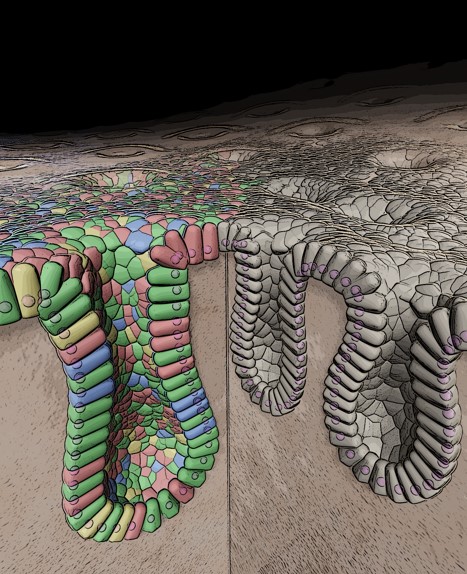
小腸、大腸などの腸管は、一層の上皮細胞によって覆われ、腸管上皮幹細胞が自己複製し、分化細胞を産生することによってその組織構造と機能を保っています。炎症など様々な原因で起こる腸管上皮の障害を修復する再生メカニズムの研究は、これまでマウスを用いた疾患モデルを用いた実験に限られてきました。しかしオルガノイド培養法の確立後、正常細胞を培養することが可能になり、大きな進展をみせています。最近では、従来の培養条件をさらに改善することで,ヒト腸管上皮細胞に含まれる多様な分化細胞を,より生体内に近い組成に再現することが可能となりました。オルガノイドを構成する1細胞レベルの遺伝子発現を解析するシングルセルRNAシークエンス解析を組み合わせることにより、これまでわからなかった様々な腸管上皮細胞の機能を解析することができるプラットフォームが構築されました。
また、組織幹細胞であるオルガノイドは、遺伝子編集などを要さずにヒトの組織からそのまま培養可能であることから、再生医療への応用が期待されています。近年若年者を中心に増加傾向である、大腸の粘膜再生障害を伴う潰瘍性大腸炎や、生命維持に必要な消化・吸収を担う小腸の機能的な不足を伴う短腸症候群などの難治性小腸疾患において、オルガノイドを用いた新規治療法開発のためのトランスレーショナルリサーチを推進すべく、研究を続けています。移植用細胞として使用するため、培養液から動物由来成分を排除し高い生物学的活性を示す無血清Afamin/Wnt3a培地の開発に大阪大学と共同で成功しました。さらに、これまで不可能であったヒトの正常腸管上皮オルガノイドを免疫不全マウスの腸管に移植する技術を開発し、移植したヒトのオルガノイドがマウス腸管内でもヒトとしての形質を保持した上皮構造を構築し、長期にわたり腫瘍化しないことが確認できました。この移植モデルでは、遺伝子改変技術によって編集したオルガノイドを用いることで、正常腸管上皮幹細胞の役割や、粘膜再生時の挙動などをマウス生体内において解析することが可能となります。また、腫瘍センターや東京医科歯科大学消化器内科と共同で大動物(ミニブタ)への内視鏡を用いた腸管上皮オルガノイド移植実験を行い、移植手技と安全性を確認しています。これらの成果は、正常オルガノイドを用いた再生医療の実現につながると期待されます。