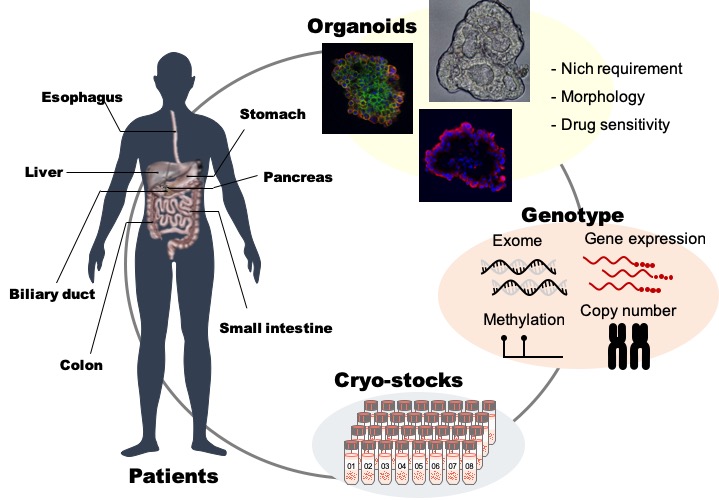
オルガノイド培養法は、幹細胞維持に必要なシグナル経路を活性化または不活性化する因子(ニッチ因子)を培養液に添加することにより幹細胞の自己複製と分化細胞産生が促し、“まるで生体内にいるかのように”生育させる技術である。ヒト正常大腸上皮の場合、WNT, RAS/MAPK, TP53, TGF-b/BMPおよびPI3K/AKTのシグナル経路と細胞外基質(マトリジェル)が幹細胞維持に必要な役割を担っており、対応するニッチ因子が必要となる。
組織によって異なる組織幹細胞のニッチ因子を最適化することによって、患者由来の大腸がん・膵臓がん・胃がん組織から8割以上という高効率で樹立することが可能になった。このように臨床で見られる多種類のがんを反映したオルガノイドを集めた「消化器がんオルガノイドライブラリー」を作ることで、より幅広い観点から大腸・膵臓・胃がんを解析し、これまで解明できなかった多様ながんの特徴やがん発生機構を紐解くことができるようになった。
大腸がんで高頻度に変異を獲得する遺伝子の多くは、正常大腸上皮幹細胞が必要な5つのシグナル経路に収束することがわかっている。大腸がんのオルガノイドは正常幹細胞で必要なシグナルに関連する遺伝子に変異を持つことによってシグナルが恒常的に活性化(または不活性化)しており、対応するニッチ因子を培養液に添加することなく増殖が可能となる。患者疾患組織からのがんオルガノイド樹立は、ニッチ依存性を直接的に調べることが可能である。
例えば胃がんにおいては、臨床マーカーHER2が高いHER2陽性胃がんが存在し、クリゾチニブという治療薬が有効である。その作用機序は、幹細胞性の維持に必要なシグナルの一つEGFシグナルのレセプターであるHER2の異常活性化を、クリゾチニブによって阻害することで細胞増殖を抑制する。そこで、多種類の胃がんから成るオルガノイドライブラリーにクリゾチニブを添加して培養してみると、HER2非陽性胃がんオルガノイドの中でも増殖抑制を示すものが見つかった。これらのオルガノイドからDNAやRNAを抽出し、次世代シークエンス解析などを用いて遺伝子変異解析や遺伝子発現解析を行うと、EGFシグナル経路を活性化する異常な変化をHER2以外に持つことが明らかになった。臨床マーカーの存在しない胃がんについても既存治療であるクリゾチニブが有効となる例がある可能性を示した。多様ながん種を反映でき、DNAやRNAを抽出することができるオルガノイドでしかできない、幅の広い解析である。
このように、消化器がんオルガノイドライブラリーをゲノム・エピゲノム・トランスクリプトームなどによって多角的に解析し、その遺伝型(genotype)変化とオルガノイドの表現型(phenotype)を比較することで、これまで解明できなかった多様ながんの特徴だけでなく、発生機構を解き明かすことができる。また、オルガノイドは超免疫不全マウスに異種移植を行うことで、生体内のがん組織を再構築することも可能である。膵がんおよび胃がんライブラリーを用いて細胞レベルで有効性を示すことができたWntシグナル標的治療が、生体内においても有効であることを示すことに成功した。このようなオルガノイドライブラリーを用いた強力な研究戦略は、胆管・肝臓・食道などの臓器も加え、さらに希少がんを含む多彩な病理型、様々な進行度のがんを含めた固形がんへ広げることが可能であり、これらの解析結果から切除不能進行がんの新規治療法の開発につながることが期待される。